心エコー図検査における精度管理に対する関心は年々高まっている.それには大きく二つの要因が考えられ,一つがISO15189(臨床検査室-品質と能力に関する特定要求事項)1)の認定取得で,ISO15189: 2012年版(第3版)から認定範囲に生理学的検査が含められるようになった.要求事項には精度管理体制の構築が含まれているが,心エコー図検査をはじめとした生理検査領域においては,呼吸機能検査を除き精度管理手法が確立されていない.もう一つが心エコー図検査の計測値そのものやその経時的変化がもつ診療への影響力である.特に左室駆出率(left ventricular ejection fraction: LVEF)は重症弁膜症に対する治療介入2),心不全の分類3),致死性不整脈に対する植込み型除細動器の適応4),がん治療関連心筋障害(cancer therapeutics related cardiac dysfunction: CTRCD)の診断・モニタリング5~7),各種循環器疾患における内服加療の適応8~10)など,臨床判断における重要な指標の一つとして診療ガイドラインに盛り込まれており,高い計測精度が求められている.
このようにISO15189認定取得・維持に代表される検査室の運用面,臨床判断への影響力という臨床面の双方から,心エコー図検査における精度管理体制構築の必要性が年々高まっている.生理検査は検査者の知識・技量が検査結果の質に大きな影響を与えるため,検査機器のみならず検査者の知識・技量に対しての精度管理体制を構築し,どの検査者が検査を実施しても同等の質の検査結果を提供できるよう検査者間での知識格差・技量格差を可能な限り小さくする取り組みが必要である.当然ながら独り立ち間もない技師と経験豊富なベテラン技師とでは知識・技量・経験全てにおいて格差があり,精度管理体制の構築でその格差が完全に解消するわけではないが,その格差を小さくする取り組みを行うことで検査室全体の底上げにつながり,結果として質の高い検査結果の提供につなげることが可能となる.しかし,検査者間差を管理する手法は確立されておらず,方法や許容範囲も各施設で独自に定めて運用しているのが実情である.
近年,coverage probability(以下,CP)と散布図を用いた検査者間差の管理方法が報告がされている5,11,12).CPとは検査者間の計測値差が事前に定めた許容範囲内に収まっている確率と定義され11),以下の式で算出される. これまで本邦において,複数施設における心エコー図検査の検査者間差管理にCPを用いた報告12)があるが,超音波検査の内部精度管理の一環としてCPを用いた報告は見当たらない.そこで自施設内でのCPを用いた検査者間差管理方法を構築することを目的とした.
対象:当院検査部で心エコー図検査に従事する臨床検査技師6名(経験年数2~18年:中央値14.5年,循環器領域の超音波検査士(registered medical sonographer; RMS)資格保有者4名)(表1),被験者は当院検査部の健常男性スタッフ5名(年齢28~36歳,中央値34歳)とした.
表1 検査者6名のプロフィール| 検査者 | 経験年数
(年) | RMS取得 |
|---|
| A | 15 | + |
| B | 18 | + |
| C | 16 | + |
| D | 14 | − |
| E | 7 | + |
| F | 2 | − |
| 中央値 | 14.5 | |
評価対象項目:左室拡張末期容量(left ventricular end diastolic volume: LVEDV),左室収縮末期容量(left ventricular end systolic volume; LVESV)およびLVEFの3項目とした.画像取得と画像評価方法:臨床検査技師6名のうちの1名(検査者A)が被験者a~eを対象に傍胸骨左室長軸像,傍胸骨左室短軸像腱索レベル・乳頭筋レベル・心尖部レベル,心尖部四腔像,心尖部二腔像,心尖部長軸像の七つの断面の動画を撮像した.また,検査部所属循環器内科医師(超音波専門医)が得られた心尖部3断面の画質をアメリカ心エコー図学会が提唱する左室17分画モデル13)に基づくセグメント毎に目視で心内膜の鮮明さを評価した(excellent:描出不良セグメントが0–2, fair:描出不良セグメントが3–5, poor:描出不良セグメントが6以上).
計測:検査者Aが取得した画像をもとに,6名の技師がそれぞれブラインドでbiplane disk summation法によりLVEDVおよびLVESVを計測し,LVEFを算出した.計測は心尖部四腔像と二腔像を用い,拡張末期は僧帽弁が閉鎖した直後で左室内腔が最大となる時相,収縮末期は僧帽弁が開放する直前で左室内腔が最小となる時相とし,ガイドライン13)に基づき緻密化心筋と左室内腔の境界をトレースした.得られたデータから評価項目ごとにCPを算出した.
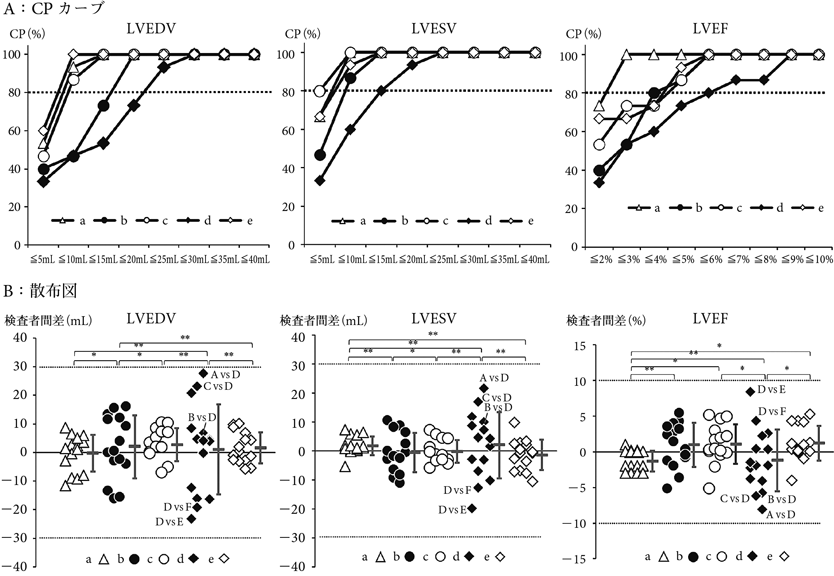
CP算出方法:計測データ取得後,検査者のすべての組み合わせで検査者間差を算出し,任意に設定した許容範囲内に収まるデータ数を求めた.最後にそのデータ数を検査者間の組み合わせ総数15で除すことでCPを算出した.CP算出例を被験者aのLVEDVのデータで示す(図1).
許容目標:既報2,11)に従い,LVEDVおよびLVESVは検査者間差30 mL以内,LVEFは検査者間差10%以内でCP≧80%になることとした.
使用機器:GEヘルスケアジャパン社製超音波診断装置VividE95,探触子は4Vc-D(セクタ型,周波数:1~6 MHz)を使用した.
統計解析:Microsoft社製Microsoft Excel2019を使用し,被験者間の検査者間計測値差(ばらつき)の検定にはF検定,再計測前後でのCPの改善の有無の検定には対応のあるt検定を用い,統計学的有意差の判定基準はp<0.05とした.
本研究は東京医科歯科大学医学部倫理審査委員会の承認のもと,被験者に書面での同意を得て行った.(承認番号M2021-220)
1)画質の評価
得られた画像の画質について,検査部所属循環器内科医師(超音波専門医)が評価した結果,被験者a, eはexcellent,被験者b, c, dはfair, poorは該当なしだった.
2)CP算出
被験者a~eの計測結果およびそれより算出したCPの結果を表2に示す.得られた結果から横軸に許容範囲,縦軸にCPをとったCPカーブ14)を作成した(図2A).LVEDVでは,被験者a, c, eは検査者間差10 mL以内,被験者bは20 mL以内,被験者dは30 mL以内でそれぞれCP≧80%となった.LVESVでは,被験者a, b, c, eは許容範囲10 mL以内,被験者dは20 mL以内でそれぞれCP≧80%となった.LVEFでは,被験者aは許容範囲3%以内,被験者bは4%以内,被験者c, eは5%以内,被験者dは6%以内でそれぞれCP≧80%となった.いずれの被験者においても検査者全体としての許容目標は達成していた.
表2 被験者a~eの計測結果とCPの結果| A:計測結果 |
|---|
| LVEDV (mL) | LVESV (mL) | LVEF (%) |
|---|
| a | b | c | d | e | a | b | c | d | e | a | b | c | d | e |
|---|
| A | 148.2 | 118.4 | 119.6 | 140.3 | 173.4 | 58.1 | 40.5 | 47.7 | 60.8 | 56.9 | 61 | 66 | 60 | 57 | 67 |
| B | 159.8 | 131.7 | 116.4 | 119.5 | 163.7 | 63.5 | 43.4 | 40.5 | 49.1 | 47.2 | 60 | 67 | 65 | 59 | 71 |
| C | 157.1 | 134.5 | 111.1 | 135.7 | 163.4 | 57.8 | 49.8 | 42.0 | 56.2 | 54.1 | 63 | 63 | 62 | 59 | 67 |
| D | 157.6 | 133.9 | 109.0 | 112.7 | 166.6 | 58.0 | 51.5 | 43.1 | 39.3 | 55.0 | 63 | 62 | 61 | 65 | 67 |
| E | 156.2 | 122.3 | 109.2 | 135.9 | 169.2 | 57.2 | 40.9 | 43.4 | 59.3 | 57.8 | 63 | 67 | 60 | 56 | 66 |
| F | 151.2 | 118.3 | 116.1 | 131.9 | 164.7 | 56.3 | 43.3 | 46.4 | 52.1 | 54.5 | 63 | 63 | 60 | 61 | 67 |
| 平均値 | 155.0 | 126.5 | 113.6 | 129.3 | 166.8 | 44.9 | 44.9 | 43.9 | 52.8 | 54.2 | 62 | 65 | 61 | 59 | 68 |
| 標準偏差 | 4.0 | 7.0 | 4.0 | 9.9 | 3.5 | 4.2 | 4.2 | 2.5 | 7.2 | 3.4 | 1 | 2 | 2 | 3 | 2 |
| 変動係数 | 2.6 | 5.6 | 3.5 | 7.6 | 2.1 | 9.4 | 9.4 | 5.6 | 13.7 | 6.3 | 2 | 3 | 3 | 5 | 3 |
| B:CPの結果 |
|---|
| 許容範囲 | CP (%) | 許容範囲 | CP (%) |
|---|
| LVEDV | LVESV | LVEF |
|---|
| a | b | c | d | e | a | b | c | d | e | a | b | c | d | e |
|---|
| 5 mL以内 | 53 | 40 | 47 | 33 | 60 | 67 | 47 | 80 | 33 | 67 | 2%以内 | 73 | 40 | 53 | 33 | 67 |
| 10 mL以内 | 93 | 47 | 87 | 47 | 100 | 100 | 87 | 100 | 60 | 93 | 3%以内 | 100 | 53 | 73 | 53 | 67 |
| 15 mL以内 | 100 | 73 | 100 | 53 | 100 | 100 | 100 | 100 | 80 | 100 | 4%以内 | 100 | 80 | 73 | 60 | 73 |
| 20 mL以内 | 100 | 100 | 100 | 73 | 100 | 100 | 100 | 100 | 93 | 100 | 5%以内 | 100 | 87 | 87 | 73 | 93 |
| 25 mL以内 | 100 | 100 | 100 | 93 | 100 | 100 | 100 | 100 | 93 | 100 | 6%以内 | 100 | 100 | 100 | 80 | 100 |
| 30 mL以内 | 100 | 100 | 100 | 100 | 100 | 100 | 100 | 100 | 100 | 100 | 7%以内 | 100 | 100 | 100 | 87 | 100 |
| 35 mL以内 | 100 | 100 | 100 | 100 | 100 | 100 | 100 | 100 | 100 | 100 | 8%以内 | 100 | 100 | 100 | 87 | 100 |
| 40 mL以内 | 100 | 100 | 100 | 100 | 100 | 100 | 100 | 100 | 100 | 100 | 9%以内 | 100 | 100 | 100 | 100 | 100 |
| | | | | | | | | | | 10%以内 | 100 | 100 | 100 | 100 | 100 |
3)ばらつき要因の検討
計測結果から縦軸に検査者間差をとった散布図を作成し,検査者間差の程度や方向を評価した(図2B).画質がexcellentであった被験者a, eと比べ,やや画質が劣る被験者b, c, d(いずれも画質はfair)でばらつきが大きい傾向にあった.その中でも他の被験者と比べ下壁~心尖部にかけて肉柱構造が発達していた被験者dでばらつきが最も大きく,F検定による有意差検討では被験者間で有意差を認めた.
4)再教育および再計測
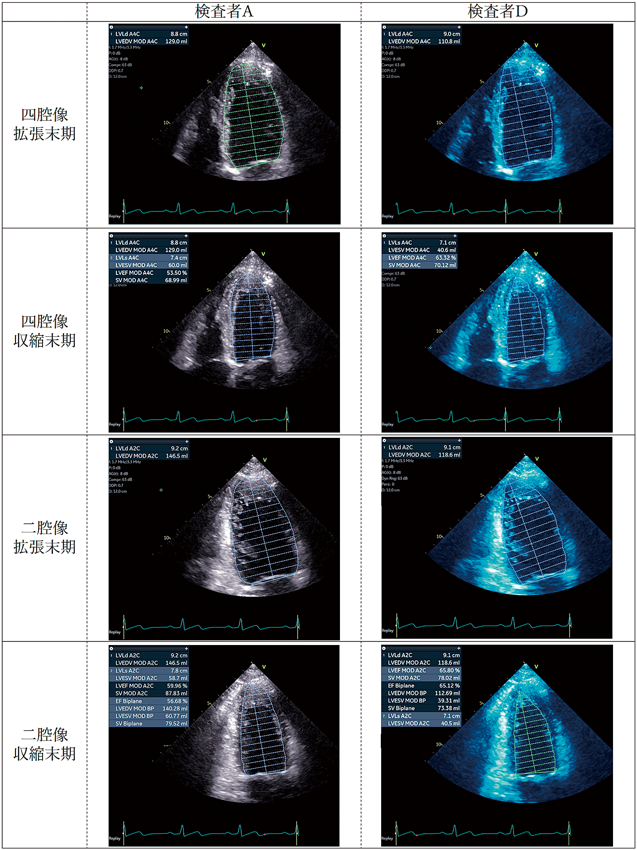
計測値差が最も大きかった検査者A(LVEDV 140.3 mL/LVESV 60.8 mL)と検査者D(LVEDV 112.7 mL/LVESV 39.3 mL)について心尖部四腔像および二腔像のトレースラインを比較した(図3).トレースラインについて情報共有した後に検査者Dに再計測してもらった.
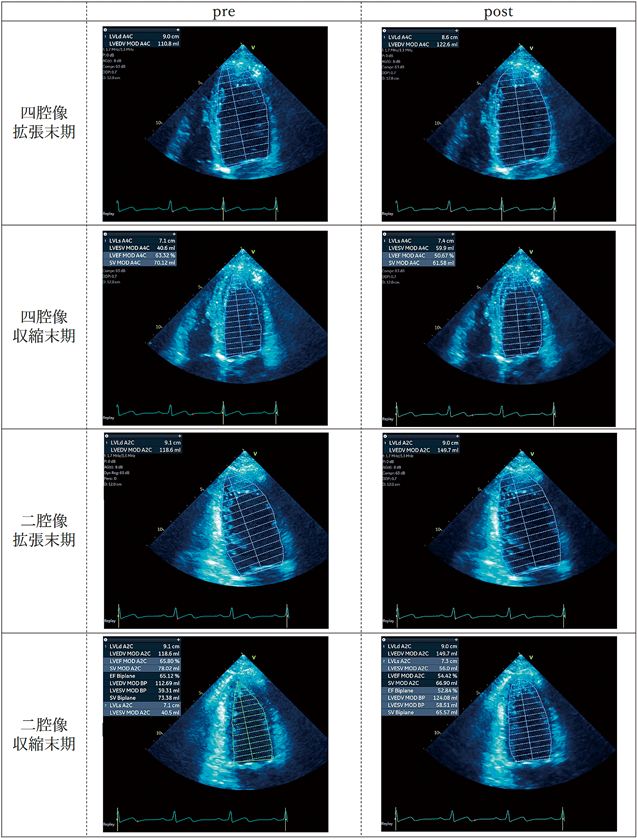
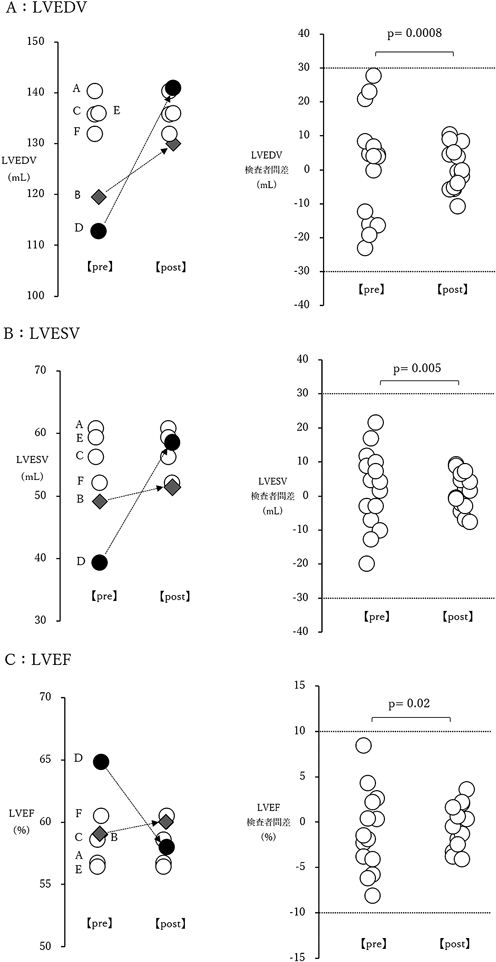
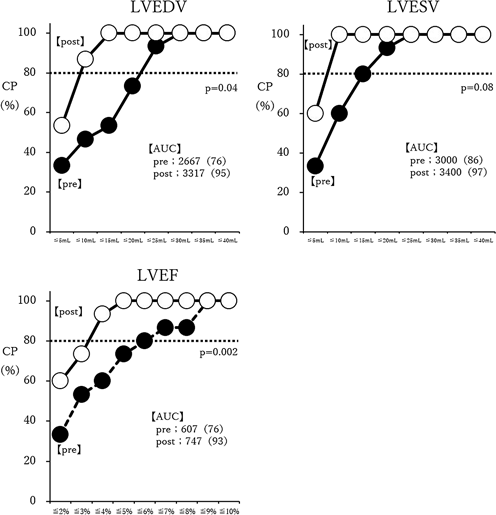
その結果,検査者Aとのトレースラインの差異は解消し,LVEDV 140.9 mL/LVESV 58.5 mLと検査者Aと同等の計測値となった(図4).同様に検査者B(LVEDV 119.5 mL/LVESV 49.1 mL)にも再計測してもらい再計測前(pre)と再計測後(post)で比較したところ,いずれの項目においても再計測後の計測値のばらつきは再計測前と比べ有意に小さくなった(図5).CPカーブはいずれの項目においても再計測後で左上方に移動した.それぞれの曲線下面積(area under the curve: AUC)を求め,再計測前後のAUCに対し対応のあるt検定による有意差検討を行った.LVEDVおよびLVEFにおいて再計測後で有意にCPカーブの改善を認めた(LVEDV; p=0.04, LVEF; p=0.002)が,LVESVにおいては有意差を認めなかった(p=0.08)(図6).
心エコー図検査は心臓の機能,構造,血行動態に関する情報を非侵襲的に簡便に把握できる日常診療に必要不可欠な検査である5,6,11,12).特にLVEFは心臓の収縮機能を簡便に評価できる指標として広く用いられ,重症弁膜症対する治療介入,心不全の分類,致死性不整脈に対する植込み型除細動器の適応,CTRCDの診断・モニタリングなど,計測値そのものやその経時的変化が判断指標の一つとなっており,精度の高い計測が求められている.その一方で,心エコー図検査における計測値の信頼性,再現性,正確性は必ずしも十分でないことは以前から指摘されている5,12,14,15).2次元心エコー図検査でのLVEFの計測誤差の限界は10%程度とされている16)が,60%↔50%,50%↔40%という10%の差が計測誤差の範疇として臨床的に許容されるかは疑わしい.3次元心エコー図による計測は画質不良がなければ2次元心エコー図検査と比べて再現性良く計測でき,検査者間差は5%程度と報告されている16, 17).しかし,3次元心エコー図対応機器を導入し日常業務に取り入れている施設はまだまだ少なく,2次元心エコー図検査における検査者間計測誤差を管理し,小さくする取り組みは極めて重要である.しかし,検査間誤差を適切に評価・管理する手法はこれまで確立されていない.
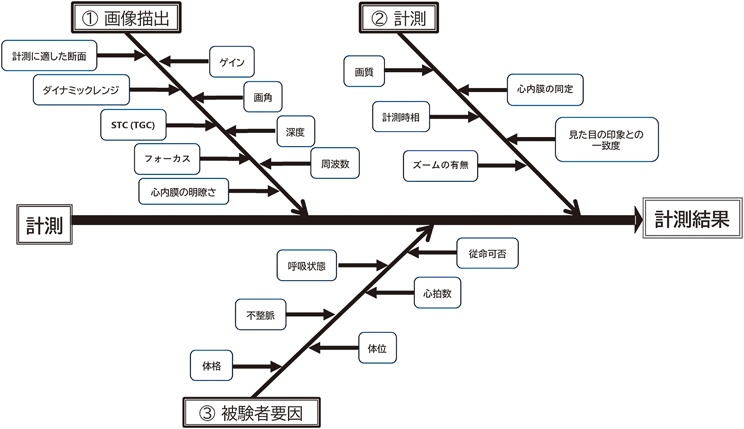
心エコー図検査における検査者間での計測誤差を評価する場合,1人の被験者に対して検査者が各々取得した画像をもとに計測し誤差を評価する方法と,1人の検査者が取得した画像をもとに複数の検査者が計測する方法の二つに大別されるが,今回の研究は後者の方法を採用した.図7にbiplane disk summation法における計測誤差の特性要因の1例を示した.計測による誤差は図7に示した個々の誤差要因により生じる誤差の総和と考えられる.検査者が各々画像取得から計測までを行う方法は,実臨床に即した方法で評価できるという利点があるが,“画像描出”,“計測”,“被験者要因”のすべての誤差要因が計測結果に影響し,計測誤差を改善する際のポイントが多岐に渡るため,計測誤差が改善された際にどの要因の改善により計測誤差が改善したのか判断しにくい問題点がある.一方,今回の検討方法は“画像描出”に関する誤差の検討ができない問題点はあるが,誤差要因は“計測”に関わる要因のみであるため,計測誤差を改善するための是正ポイントを絞りやすく,是正処置の効果の適切性を判断しやすいという利点がある.そのため,“計測”に関する誤差要因を検査者間で共有・検討し,一定の改善が得られた段階で,次のステップとして“画像描出”も含めた検査者間誤差を検討するのが良いと考え,今回の方法を採用した.
心エコー図検査の検査者間誤差の管理にCPを初めて用いたのは2015年のDaubertら11)とされている.彼らは評価項目ごとに許容基準(表3)を設定してCP≧80%を許容できる検査者間差と定義し,心エコー図検査の計測・レビュー・リトレーニングの教育プログラムで,リトレーニング後の計測値差のばらつきが改善するかをCPと散布図を用いて評価した研究を報告した.この報告の中で彼らはデータの一致性や再現性の指標としてこれまで頻用されているピアソンの相関係数,級内相関係数,変動係数などの限界として,グループ全体の情報を示すことができるものの検査者個人のデータのばらつきに関する情報が得られない点を指摘している.一方でCPと散布図を用いた方法は検査者全体だけでなく,検査者個人のデータのばらつきも評価できる点を利点として挙げている.また,散布図を用いることで検査者間差の程度や方向が視覚的・直観的に把握できる点,検査者間差をとることで少数の検査者グループでもある程度のデータ量を得ることができる点,比較のためのgold standardや基準検者への依存性が低い点も利点であると述べている.Clowlyら14)は心エコー図検査の再現性に関する20報のメタ解析の中で,得られたCPのデータからCPカーブを作成し視覚的に評価する手法を提唱した.散布図は検査者個人の計測値のばらつきの程度と方向をみえる化するツールであるのに対し,CPカーブは検査者全体のばらつきの収束具合をみえる化するツールであると考えられ,両者を組み合わせることで相補的に機能すると考えられる.
表3 評価項目ごとの許容基準(文献5より改変引用)| 評価項目 | 許容基準 |
|---|
| LVEDV (mL) | 30 |
| Biplane EF (%) | 10 |
| MR | ≦1 sequential grade※ |
| AR | ≦1 sequential grade※ |
| LVOT diameter (cm) | 0.2 |
| AV peak pressure gradient (mmHg) | 20 |
| AV mean pressure gradient (mmHg) | 10 |
| AVA (cm2) | 0.3 |
MR; mitral regurgitation, AR; aortic regurgitation
LVOT; left ventricular outflow tract, AV; aortic valve, AVA; aortic valve area
※5段階評価(none, trace, mild, moderate, severe) |
例えば被験者dにおけるLVEDVの計測データ(表2)において,平均値,標準偏差,変動係数のみでは検査者6名全体のデータのばらつきやその程度は把握できるものの,個々の検査者の計測データに対するフィードバックとしては十分ではない.その点,CPカーブと散布図を組み合わせることで,任意に設定した許容範囲に対する検査者全体での達成度をCPカーブで,データ間のばらつきの方向と程度という検査者個々の情報を散布図で示すことができる.postのCPカーブはpreと比較しいずれの項目においても左上方に移動し,各項目における再計測前後でのAUCの比較では,LVEDVおよびLVEFでは統計学的有意差を認めたものの,LVESVでは有意差は認めなかった(図6).LVEDVおよびLVESVとLVEFではCPカーブの横軸の単位が異なり,そこから求めたAUCの単位も異なるため,AUCの値そのものを直接比較することはできない.そこでAUCの値を横軸の範囲で除した値(スケーリングAUC)を用いることで3項目を同列に比較することが可能となる.スケーリングAUCのpostの値は3項目ともほぼ同等だったが,preの値はLVESVが他の2項目と比べ高く,その結果改善幅が小さくなりLVESVでは有意差がみられなかったと考えられる.本研究においては被験者dの計測値のばらつきについて,散布図を用いることでばらつきの主たる要因となった検査者とばらつきの原因を速やかに特定でき,それに対して講じた是正処置前後のばらつきの改善度を視覚的に評価することができた点で有用であった.このようにCPカーブと散布図を組み合わせた手法は,許容範囲の設定(Plan)→計測(Do)→評価(Check)→再教育・再計測・再評価(Action)というPDCAサイクルを回し検査者間差を評価・管理できる有用な手法である.
本研究にはいくつかのlimitationが存在する.1点目は本研究は健常被験者5名を対象としたもので左室容量やLVEFがいずれも正常範囲内のケースのみであり,左室拡大症例や左室収縮機能低下症例においての検査者間差は検討できていない.検体検査の精度管理においては正常域と異常域の2濃度以上の精度管理試料を用いて管理することが一般的であり,心エコー図検査においても異常域のデータも含めた検査者間差管理の実施が望ましいと考えられ今後の課題である.2点目は今回用いた各指標の許容目標(LVEDVおよびLVESV;検査者間差30 mL以内でのCP≧80%,LVEF;検査者間差10%以内でのCP≧80%)の妥当性であり,Daubertらの研究でもこの点をlimitationとしている.その後のCPを用いた研究5,12)においてもこの許容目標を踏襲しているが,許容目標の妥当性に言及・検証した報告は見当たらず,今後さらなるデータの蓄積が必要であると考えられる.3点目は本研究での方法で評価できるのは検査者間のばらつき(精密度)のみで,正確度(真値との差)は評価できていない点である.今回被験者dのLVEDVの計測値は110~120 mLの低値群と130~140 mLの高値群に大きく2群に分かれた(図5左).画像とトレースラインを見直した結果,後者の方が妥当と考え,低値群の検査者に高値群の値に近づくようトレースラインを修正してもらい検査者全体のばらつきを小さくした(精密度は向上)が,被験者dのLVEDVの真値は不明であるため,正確度についての評価はできない.左室容量(LVEDV・LVESV)計測における正確度の基準がそもそも存在しない現状においては,検査者間でのばらつき(精密度)を小さくするような取り組みに主眼を置くのが現実的であると考える.
Coverage probabilityと散布図を用いた自施設における検査者間差管理方法を構築した.本法は検査者全体および検査者個人の計測値のばらつきを簡便に視覚的に評価できる有用な方法である.
本論文の内容は第48回日本超音波検査学会学術集会において発表した.
引用文献References
1) ISO15189: 2012: Medical laboratories—Requirements for quality and competence, 3rd edition, 2012-11-01, reference no.ISO15189: 2012(国際規格ISO15189 臨床検査室—品質と能力に関する特定要求事項 第3版,2012年11月1日,英和対訳版)
2) 日本循環器学会ガイドライン「弁膜症治療のガイドライン」(2020年改訂版).https://www.j-circ.or.jp/cms/wp-content/uploads/2020/04/JCS2020_Izumi_Eishi.pdf(2023年10月アクセス)
3) 日本循環器学会ガイドライン「2021年JCS/JHFSガイドライン フォーカスアップデート版 急性・慢性心不全診療」.https://www.j-circ.or.jp/cms/wp-content/uploads/2021/03/JCS2021_Tsutsui.pdf(2023年10月アクセス)
4) 日本循環器学会ガイドライン「不整脈の非薬物治療ガイドライン」(2018年改訂版).https://www.j-circ.or.jp/cms/wp-content/uploads/2018/07/JCS2018_kurita_nogami.pdf(2023年10月アクセス)
5) Khouri GM, Ky B, Dunn G, et al. Echocardiography core laboratory reproducibility of cardiac safety assessments in cardio-oncology. J Am Soc Echocardiogr 2018; 31(3): 361–371.
6) 日本心エコー図学会:抗がん剤治療関連心筋障害の診療における心エコー図検査の手引.http://www.jse.gr.jp/contents/guideline/data/guideline_onco2020-10.pdf(2023年8月閲覧)
7) Zamorano JL, Lancellotti P, Munoz DR, et al. 2016ESC position paper on cancer treatments and cardiovascular toxicity developed under the auspices of the ESC committee for practice guideline. Eur Heart J 2016; 37(36): 2768–2801.
8) 日本循環器学会ガイドライン「慢性冠動脈疾患診断ガイドライン」(2018年改訂版).https://www.j-circ.or.jp/cms/wp-content/uploads/2018/10/JCS2018_yamagishi_tamaki.pdf(2023年10月アクセス)
9) 日本循環器学会ガイドライン「心筋症診療ガイドライン」(2018年改訂版).https://www.j-circ.or.jp/cms/wp-content/uploads/2018/08/JCS2018_tsutsui_kitaoka.pdf(2023年10月アクセス)
10) 日本循環器学会ガイドライン「不整脈薬物治療ガイドライン」(2020年改訂版).https://www.j-circ.or.jp/cms/wp-content/uploads/2020/01/JCS2020_Ono.pdf(2023年10月アクセス)
11) Daubert MA, Yow E, Barnhart HX, et al. Quality improvement implementation: improving reproducibility in the echocardiography laboratory. J Am Soc Echocardiogr 2015; 28(8): 959–968.
12) Nabeshima Y, Namisaki H, Teshima T, et al. Impact of training program incorporating cardiac magnetic resonance imaging on the accuracy and reproducibility of two-dimensional echocardiographic measurements of left ventricular volumes and ejection fraction. Cardiovasc Ultrasound 2019; 17(1): 23.
13) Lang RM, Badano LP, Mor-Avi V, et al. Recommendations for cardiac chamber quantification by echocardiography in adults: An update from the American Society of Echocardiography and the European Association of Cardiovascular Imaging. J Am Soc Echocardiogr 2015; 28(1): 1–39.
14) Clowly AL, Yow E, Barnhart HX, et al. Critical review of current approaches for echocardiographic reproducibility and reliability assessment in clinical research. J Am Soc Echocardiogr 2016; 29(12): 1144–1154.
15) Dorosz JL, Lezotte DC, Weitzenkamp DA, et al. Performance of 3-dimensional echocardiography in measuring left ventricular volumes and ejection fraction. J Am Coll Cardiol 2012; 59(29): 1799–1808.
16) Thavendiranathan P, Grant AD, Negishi T, et al. Reproducibility of echocardiographic techniques for sequential assessment of left ventricular ejection fraction and volumes. J Am Coll Cardiol 2013; 61(1): 77–84.
17) Tsang W, Salgo IS, Medvedofsky D, et al. Transthoracic 3D echocardiographic left heart chamber quantification using an automated adaptive analytics algorithm. JACC Cardiovasc Imaging 2016; 9(7): 769–782.