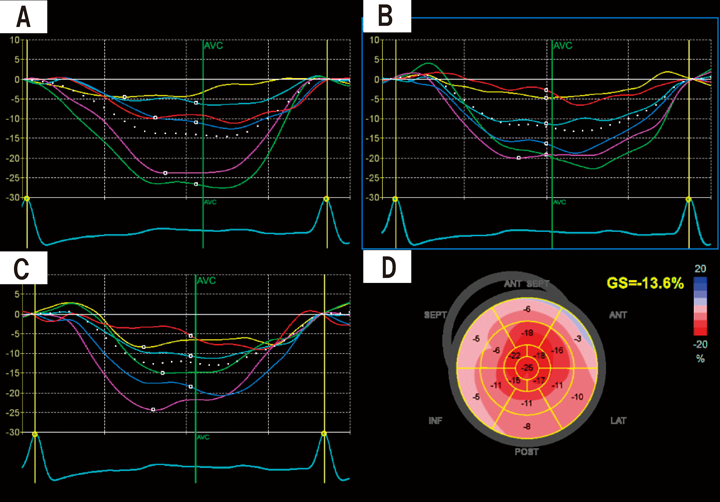
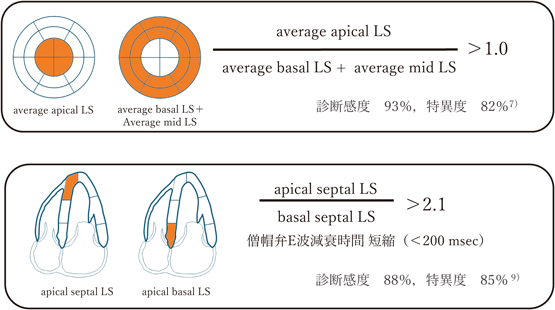
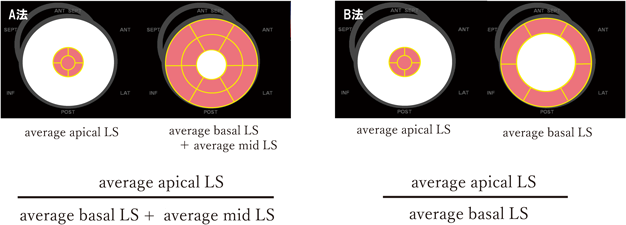
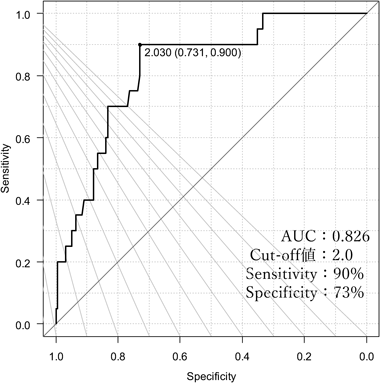
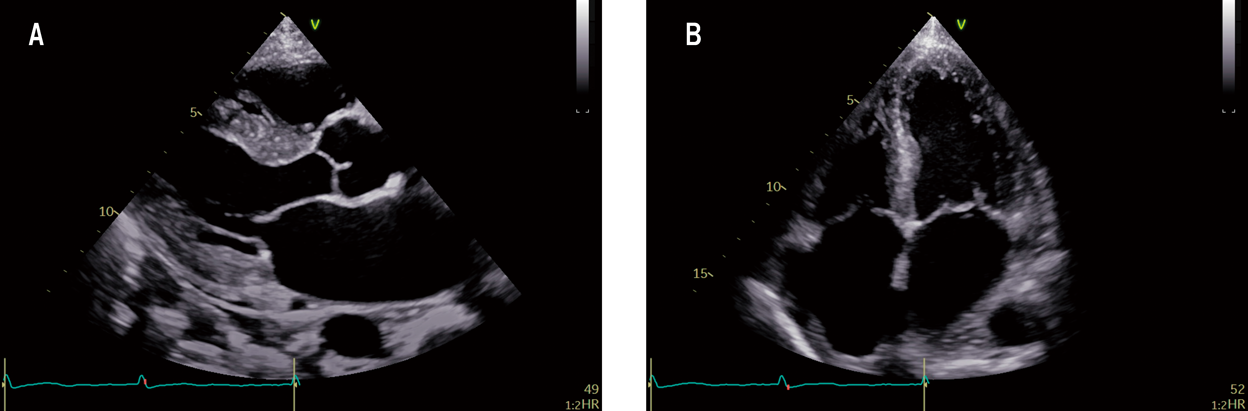
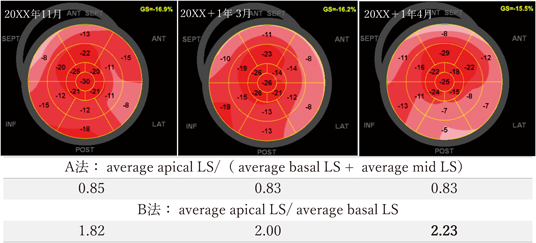
左室longitudinal strainにおけるapical sparing判定基準の検討Examining the Criteria for Apical Sparing in Left Ventricular Longitudinal Strain
辻本 恵美1,戸出 浩之1,澤田 健太1,木村 紀子1,長谷川 ゆみ1,秋山 真琴1,本多 飛鳥1,華 臻圣2,越川 優里2,板橋 裕史1,2,小林 さゆき1,2Emi Tsujimoto1, Hiroyuki Toide1, Kenta Sawada1, Noriko Kimura1, Yumi Hasegawa1, Makoto Akiyama1, Asuka Honda1, Shinsei Hana2, Yuri Koshikawa2, Yuji Itabashi1,2, Sayuki Kobayashi1,2
1 獨協医科大学埼玉医療センター超音波センターDokkyo Medical University Saitama Medical Center, Center of Medical Ultrasonics
2 獨協医科大学埼玉医療センター循環器内科Dokkyo Medical University Saitama Medical Center, Cardiovascular Medicine
受付日:2023年12月8日Received: December 8, 2023
受理日:2024年7月16日Accepted: July 16, 2024
発行日:2024年10月1日Published: October 1, 2024